سولفات منیزیم چیست؟| خواص، روش تولید و کاربردهای منیزیم سولفات

سولفات منیزیم چیست؟ | ویژگیها، روش تولید و کاربردهای آن
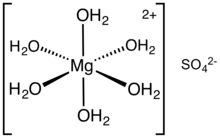
سولفات منیزیم (منیزیم سولفات) یک ترکیب شیمیایی است ، نمکی با فرمول MgSO4، متشکل از کاتیونهای منیزیم Mg+۲ (۲۰.۱۹٪ از نظر جرمی) و آنیونهای سولفات SO–۲ ، یک ماده جامد بلوری سفید است که در آب، محلول است اما در اتانول حل نمیشود.
منیزیم سولفات معمولاً به صورت هیدراته با فرمول عمومی MgSO.nH2O یافت میشود. n دارای مقادیر مختلف بین ۱ تا ۱۱است. متداولترین فرم هیدارته این نمک معدنی، هپتاهیدرات با فرمول مولکولی MgSO.7H2O است که به به نمک اپسوم (Epsom salt) شهرت دارد. نمک اپسوم یک ماده شیمیایی خانگی با کاربردهای سنتی از جمله نمکهای حمام است.
کاربرد اصلی نمک سولفات منیزیم در کشاورزی، برای اصلاح خاکهایی با کمبود منیزیم (= یک ماده مغذی ضروری گیاه) است. فرم ساختاری مونوهیدرات نمک معدنی منیزیم سولفات برای این استفاده بسیار مطلوب است.
در اواسط دهه ۱۹۷۰، تولید منیزیم سولفات، ۲.۳ میلیون تن در سال بود. شکل منیزیم سولفات بی آب و چندین شکل از ساختار هیدراته در طبیعت به صورت مواد معدنی به طور طبیعی وجود دارد و این نمک، بخش قابل توجهی از آب برخی چشمهها است.
فهرست مطالب
روشهای تولید سولفات منیزیم چیست
۱-منبع طبیعی از نمک منیزیم سولفات
سولفاتهای منیزیم، مواد معدنی رایج در پدیدههای زمین شناسی هستند. شکل گیری آنها بیشتر با فرآیندهای supergene مرتبط است. برخی از این ساختارها نیز سازندههای مهم رسوبات تبخیری نمکهای پتاسیم-منیزیم (K-Mg) هستند.
تقریباً همه اشکال معدنی شناخته شده از نمک MgSO4، به فرم ساختاری هیدراته هستند. اپسومیت، ساختار مشابه طبیعی “نمک اپسوم” است. مریدانیانیت، MgSO4.11H2O، در سطح دریاچههای یخ زده مشاهده شده است و تصور میشود که در مریخ نیز وجود داشته باشد.
هگزا هیدراته، فرم بعدی از این نمک است که به صورت متداول یافت میشود. پس از آن میتوان ساختارهای تری هیدراته و پنتا هیدراته را یافت که با احتمال کمتری وجود دارند. نمک معدنی “کیزریت”، ساختار مونو هیدراته منیزیم سولفات است و در بین رسوبات تبخیری، شایعتر است. گزارش شده است سولفات منیزیم بی آب از برخی از مخازن سوخت ذغال سنگ به دست میآید.
۲-تهیه سولفات منیزیم با استفاده از اسید سولفوریک
سولفات منیزیم معمولاً مستقیماً از بسترهای خشک دریاچه و سایر منابع طبیعی به دست میآید. همچنین میتوان آن را از واکنش منیزیت (فرم کربنات منیزیم، MgCO3) یا یا منیزیا (فرم اکسید، MgO) با اسید سولفوریک تهیه کرد.
روش دیگر، تصفیه آب دریا یا پسابهای صنعتی حاوی منیزیم است تا هیدروکسید منیزیم رسوب کرده و رسوب با اسید سولفوریک واکنش دهد و سپس ترکیب منیزیم سولفات به حاصل شود.
خواص و کاربردها
سولفات منیزیم میتواند به صورت چند ساختار هیدراته متبلور شود. این ساختارها را در قسمت زیر مشاهده میکنید:
۱- منیزیم سولفات بی آب: در طبیعت، ناپایدار است؛ میتواند به فرم هیدراته تبدیل شود و اپسومیت را ایجاد کند.
۲- سولفات منیزیم مونوهیدرات: kieserite؛ monoclinic
۳- ساختار هیدراته منیزیم سولفات با فرمولهای MgSO4. 1.25H2O و یا ۸MgSO4. 10H2O
۴- ساختار دی هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 2H2O ؛ orthorhombic
۵- ساختار نمک با فرمول MgSO4. 2.5H2O و یا ۲MgSO4. 5H2O
۶- ساختارتری هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 3H2O
۷- ساختار تترا هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 4H2O؛ مونوکیلینیک
۸- ساختار پنتا هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 5H2O؛ تری کیلینیک
۹- ساختار هگزا هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 6H2O؛ مونوکیلینیک
۱۰- ساختار هپتا هیدراته سولفات منیزیم یا دو آبه با فرمول MgSO4. 7H2O؛ اپسومیت؛ اورتو رومبیک
۱۱- ساختار اکتا هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 8H2O؛ مونوکیلینیک
۱۲- ساختار دکا هیدراته منیزیم سولفات یا دو آبه با فرمول MgSO4. 10H2O
۱۳- ساختار آندکا هیدراته سولفات منیزیم یا دو آبه با فرمول MgSO4. 11H2O؛ تری کیلینیک
تمام ساختارهای هیدراته با گرم شدن، آب خود را از دست میدهند. در دمای بالای ۳۲۰ درجه سانتیگراد، فقط فرم بی آب، پایدار است. بدون ذوب شدن در دمای ۱۱۲۴ درجه سانتیگراد، سولفات منیزیم به اکسید منیزیم (MgO) و تری اکسید گوگرد (SO3) تجزیه میشود.

سولفات منیزیم هپتاهیدراته
*درباره ساختار سولفات منیزیم هپتا هیدراته (نمک اپسوم)
منیزیم سولفات هپتا هیدراته، نام خود را با “نمک اپسوم”، از یک چشمه شور در “اپسوم” در Surrey، در جنوب شرقی انگلیس گرفته است؛ جایی که نمک از چشمهها تولید میشود.
منیزیم سولفات هپتا هیدراته به راحتی یک مولکول آب از دست میدهد تا فرم هگزا هیدراته تشکیل شود.
این نمک، یک منبع طبیعی و آلی از منیزیم و گوگرد است. نمکهای Epsom معمولاً در نمکهای حمام، لایه بردارها، شل کنندههای عضلات و مسکنها استفاده میشوند. با این حال، این ساختار منیزیم سولفات با نمکهای Epsom که برای باغبانی استفاده میشوند متفاوت هستند.
*درباره ساختار منیزیم سولفات مونوهیدراته:
منیزیم سولفات مونو هیدراته را میتوان با حرارت دادن منیزیم سولفات هگزا هیدراته تا حدود ۱۵۰ درجه سانتی گراد تهیه کرد. گرم شدن بیشتر تا حدود ۳۰۰-۳۲۰ درجه سانتیگراد، سولفات منیزیم بی آب را حاصل میکند.
*درباره ساختار منیزیم سولفات ۱۱ آبه:
منیزیم سولفات ۱۱ آبه، مریدیانیت، فقط در فشار جو، کمتر از ۲ درجه سانتیگراد، پایدار است. بالاتر از این دما، به مخلوط هپتا هیدراته جامد و محلول اشباع تبدیل میشود. کریستالهای بزرگ این نوع ساختار را میتوان از محلولهایی با غلظت مناسب که برای چند روز در ۰ درجه سانتیگراد نگهداری میشوند، به دست آورد.
مشخصات فیزیکی و شیمیایی سولفات منیزیم
| سولفات منیزیمMagnesium sulfate | |
|
فرم هگزا هیدراته/ hexahydrate |
|
|
منیزیم سولفات بدون آبAnhydrous magnesium sulfate |
|
|
اپسوم – نمک هپتا هیدراته یا فرم ۷ آبهEpsomite (heptahydrate) |
|
| نام ترکیب | |
| IUPAC نامگذاری Magnesium sulfate سولفات منیزیم |
|
| نامهای متداول دیگر Epsom salt (heptahydrate) نمک اپسوم / هپتا هیدراته English salt نمک انگلیسی Bitter salts نمک بیتر Bath salts نمک حمام |
|
| شاخصهای شناسایی | |
| ۷۴۸۷-۸۸-۹ (فرم بدون آب) ۱۴۱۶۸-۷۳-۱ (فرم مونو هیدراته) ۲۴۳۷۸-۳۱-۲ (فرم تری هیدراته) ۱۵۵۵۳-۲۱-۶ (فرم پنتا هیدراته) ۱۳۷۷۸-۹۷-۷ (فرم هگزا هیدراته) ۱۰۰۳۴-۹۹-۸ (فرم هپتا هیدراته) |
CAS Number |
| E518 | E number |
| ۲۴۰۸۳ | PubChem CID |
| ویژگیها و خواص | |
| MgSO۴ | فرمول شیمیایی |
| ۱۲۰.۳۶۶ g/mol (فرم بدون آب) ۱۳۸.۳۸ g/mol (فرم مونو هیدراته) ۱۷۴.۴۱ g/mol (فرم تری هیدراته) ۲۱۰.۴۴ g/mol (فرم پنتا هیدراته) ۲۲۸.۴۶ g/mol (فرم هگزا هیدراته) ۲۴۶.۴۷ g/mol (فرم هپتا هیدراته) |
جرم مولی |
| کریستالهای سفید شفاف | شکل ظاهری |
| بدون بو | بو |
| ۲.۶۶ g/cm۳ (فرم بدون آب) ۲.۴۴۵ g/cm۳ (فرم مونو هیدراته) ۱.۶۸ g/cm۳ (فرم هپتا هیدراته) ۱.۵۱۲ g/cm۳ (فرم ۱۱ آبه) |
دانسیته |
| فرم بدون آب در دمای ۱,۱۲۴ درجه سانتیگراد تجزیه میشود فرم مونو هیدراته در دمای ۲۰۰ درجه سانتیگراد تجزیه میشود فرم هپتا هیدراته در دمای ۱۵۰ درجه سانتیگراد تجزیه میشود فرم ۱۱ آبه در دمای ۲ درجه سانتیگراد تجزیه میشود |
نقطه ذوب |
| ۱,۴۲۰ °C (2,590 °F; 1,690 K) | نقطه جوش |
| فرم بدون آب ۲۶.۹ g/100 mL (0 °C) ۳۵.۱ g/100 mL (20 °C) ۵۰.۲ g/100 mL (100 °C) فرم ۷ آبه ۱۱۳ g/100 mL (20 °C) |
حلالیت در آب |
| ۱.۱۶ g/100 mL (18 °C, اتر) در الکل و گلیسرول به آرامی حل میشود در استون، نا محلول است |
حلالیت در سایر ترکیبات |
| ویژگیهای ساختاری | |
| مونو کیلینیک – به فرم هیدراته | ساختار کریستالی |
| ترکیبات مرتبط | |
| Beryllium sulfate سولفات برلیوم Calcium sulfate سولفات کلسیم Strontium sulfate سولفات استرانسیوم Barium sulfate سولفات باریم |
کاتیونهای مربوطه |
کاربردهای سولفات منیزیم
۱- کاربرد در پزشکی
منیزیم سولفات هم برای مصارف بیرونی (به عنوان نمک اپسوم) و هم برای کاربردهای داخلی استفاده میشود.
کاربرد خارجی منیزیم سولفات استفاده از آن در فرمولاسیون تهیه نمکهای حمام است؛ به ویژه برای شستشوی پا برای تسکین درد پا. ادعا شده است که چنین حمامی باعث تسکین و تسریع بهبودی درد عضلانی و آسیب میشود. اما این ادعاها از نظر علمی تأیید نشدهاند.
فواید اصلی نمک منیزیم سولفات در تهیه مواد آرایشی است. این یکی از کاربردهای بیرونی منیزیم سولفات است. محصولاتی که حاوی این ترکیب هستند، از چروک شدن موقتی پوست ناشی از تماس طولانی مدت با آب جلوگیری میکنند. این ماده همچنین جزء متداول و معمول محلولهای مورد استفاده در مخازن جداسازی است.
از کاربردهای منیزیم سولفات خوراکی به صورت داخل بدن، داروهایی هستند که ممکن است از طریق دهان، تنفس یا راههای تزریق داخل وریدی، تجویز شوند. استفادههای داخلی شامل درمان جایگزینی برای کمبود منیزیم، درمان آریتمی حاد و شدید، به عنوان یک گشاد کننده برونش در درمان آسم، و پیشگیری از کلامپسی (=منیزیم سولفات در پری-کلامپسی) است.
سولفات منیزیم در داروسازی۲- کشاورزی
از سولفات منیزیم در کشاورزی برای افزایش میزان منیزیم یا گوگرد در خاک استفاده میشود. این ماده معمولاً روی گیاهان گلدانی یا محصولات نیازمند به منیزیم مانند سیب زمینی، گوجه فرنگی، هویج، فلفل، لیمو و گل رز استفاده میشود.
مزیت سولفات منیزیم نسبت به سایر اصلاح کنندههای خاک حاوی منیزیم (مانند آهک دولومیتی) حلالیت زیاد آن است؛ این ویژگی، تغذیه خاک را از طریق محلول پاشی امکان پذیر میکند.
محلولهای منیزیم سولفات نیز در مقایسه با نمکهای قلیایی منیزیم که در سنگ آهک یافت میشود، تقریباً دارای PH خنثی هستند. بنابراین، استفاده از منیزیم سولفات به عنوان منبع منیزیم برای خاک، pH خاک را به میزان قابل توجهی تغییر نمیدهد.
سولفات منیزیم در طول تاریخ، به عنوان درمانی برای مسمومیت با سرب، قبل مورد استفاده قرار میگرفت. تصور بر آن بود که سرب بلعیده شده توسط سولفات منیزیم رسوب کرده و متعاقباً از طریق دستگاه گوارش، پاکسازی میشود. این روش به ویژه از اوایل تا اواسط قرن بیستم مورد استفاده گسترده دامپزشکان قرار گرفت.
نمک اپسوم در بسیاری از مزارع برای مصارف کشاورزی در دسترس بود و اغلب برای معالجه حیوانات مزرعه که تصادفی، سرب را میخورند، تجویز میشد.
۳-آماده سازی مواد غذایی
از سولفات منیزیم به عنوان یک ماده منعقد کننده برای ساخت برخی غذاهای آماده طبخ مانند “توفو” استفاده شود.
۴-ساختمان سازی
از سولفات منیزیم در ساختمان سازی برای تهیه سیمانهای خاص، از واکنش بین اکسید منیزیم و محلول منیزیم سولفات، استفاده میشود؛ سیمانهایی که توانایی اتصال و مقاومت بیشتری نسبت به سیمان پرتلند دارند. این سیمان عمدتاً در تولید پانلهای عایق با وزن سبک استفاده میشود. ضعف مقاومت در برابر آب، استفاده از آن را محدودتر میکند.
۵- آکواریوم
سولفات منیزیم هپتا هیدراته، برای حفظ غلظت منیزیم در آکواریومهای دریایی که حاوی تعداد زیادی مرجانهای سنگی هستند استفاده میشود؛ همان طور که در مرحله کلسیفیکاسیون آنها به آرامی تخلیه میشود. در یک آکواریوم دریایی با کمبود منیزیم، کنترل غلظت کلسیم و خاصیت قلیایی، بسیار دشوار است زیرا منیزیم کافی برای تثبیت این یونها در آب شور و جلوگیری از رسوب خود به خودی آنها در کربنات کلسیم وجود ندارد.
۶-نمکهای دوتایی منیزیم سولفات
نمکهای دوتایی حاوی سولفات منیزیم وجود دارد. چند مورد به عنوان سولفاتهای منیزیم – سدیم و سولفاتهای منیزیم – پتاسیم شناخته شدهاند. مخلوط سولفات مس و منیزیم هپتا هیدراته اخیراً یافت شده است که در نخالههای معدن وجود دارد و به آن نام معدنی آلپرزیت را دادهاند.
ایمنی سولفات منیزیم
شکل ظاهری منیزیم سولفات، جامد سفید تا خاکستری است. تماس با این ترکیب ممکن است باعث تحریک چشم، پوست و دستگاه تنفسی شود.
در صورت بلع تصادفی، استنشاق یا جذب شدن از طریق پوست ممکن است مضر باشد. این ترکیب، گاهی نمناک است (رطوبت هوا را جذب میکند). خصوصیات سم شناسی این ماده به طور کامل بررسی نشده است.
اگر این ترکیب به صورت تصادفی بلعیده شود ممکن است با حالت تهوع، استفراغ و اسهال باعث تحریک دستگاه گوارش شود. در صورت فرو بردن در سیستم گوارشی، ممکن است آسیب زننده باشد. اگر افراد، غبارات منتشر شده از این ترکیب را استنشاق کنند، ممکن است باعث تحریک دستگاه تنفسی شود.
در معرض هوای مرطوب یا آب میتواند رطوب را جذب کند. عوامل اکسید کننده قوی، در صورت گرم شدن با الکلهای اتوکسی اتیلن، قابلیت انفجاری پیدا میکند.
محصولات تجزیهای خطرناک از منیزیم سولفات، شامل اکسیدهای گوگرد (SOx) از جمله اکسید گوگرد و دی اکسید گوگرد و اکسیدهای منیزیم است. پلیمریزاسیون خطرناک رخ نخواهد داد.
شرایط نگهداری
برای حمل و نقل و جابجایی منیزیم سولفات سعی کنید که تولید و جمع شدن گرد و غبار را به حداقل برسانید. از تماس با پوست، چشم و لباسهای کار اجتناب شود. از خوردن و استنشاق غبارات خودداری کنید.
بسته بندیهای حاوی ترکیب منیزیم سولفات باید در جای خشک و خنک نگهداری شود. منیزیم سولفات پودری و کریستالی در ظرف محکم و درب بسته نگهداری شود. انبار را از رطوبت محافظت کنید.
بسته بندی

بسته بندی سولفات منیزیممنیزیم سولفات در بسته بندیهای کیسهای و با وزن استاندارد ۲۵ کیلوگرم به فروش میرسد. در صورت ثبت سفارش عمده، این نمک معدنی در کیسههای جامبو بگ با وزن ۱۰۰۰ کیلوگرم آماده ارسال برای مشتری است. نمک اپسوم در کشاورزی، پرفروشترین محصول است که با تقاضای زیادی در بازار روبرو است. اکثر خریداران، حمل فلهای را درخواست میکنند.
بازار و خرید و فروش سولفات منیزیم
خرید و فروش سولفات منیزیم خوراکی و منیزیم سولفات صنعتی برای مصارف مختلف در بسته بندیهای مختلف ارائه میشود. مصارف کشاورزی و دارویی این نمک معدنی بسیار شناخته شده است. قیمت نمک اپسوم و قیمت سولفات منیزیم در ساختارهای هیدراته متنوع بر اساس درصد خلوص آنها تعیین میشود.
منیزیم سولفات به صورت کریستالی و با درصد خلوص ۱۲% ، ۱۶% و بالای ۹۸% به فروش میرسد. کود سولفات منیزیم در کشاورزی نیز به صورت کیسهای تأمین میشود.
 مقالات مربوط به سایر مواد شیمیایی
مقالات مربوط به سایر مواد شیمیایی
منابع:
https://en.wikipedia.org/wiki/Magnesium_sulfate
آخرین دیده شده ها
















 (4 امتیاز)
(4 امتیاز)

دیدگاه کاربران
سود پرک چیست؟ همه چیز درباره سود سوز آور
آدیپیک اسید چیست و چه کاربردهایی دارد؟
کاربردهای آنتی اکسیدان ۱۰۱۰ چیست؟
نگهداری مواد شیمیایی در انبار استاندارد دارای چه ویژگی هایی است؟
آشنایی با طبقهبندی مواد خطرناک (IMDG Code)
با مواد اولیه بازیافت، مراحل بازیافت و نکات مهم آن آشنا شویم
شرکت پرسال تامین کننده اسید فسفریک خوراکی
هیدرازین چیست؟ روش تولید، ۲۳ کاربرد هیدرازین
مواد اولیه نساجی و مواد شیمیایی مورد استفاده آن چه هستند؟
کاربردهای اسیدهای شیمیایی در صنایع غذایی
چگونه از خاکستر برای تغذیه و تقویت گیاهان خود استفاده کنید؟
کاربرد کلروپتاس در گل حفاری چیست؟
سود پرک چیست؟ همه چیز درباره سود سوز آور
۱۰ روش موثر برای باز کردن لوله فاضلاب سینک ظرفشویی با ترفندهای خانگی
بیست و هشتمین نمایشگاه بین المللی نفت، گاز، پالایش و پتروشیمی
۳۱امین نمایشگاه بینالمللی ایران بیوتی
دومین نمایشگاه و کنفرانس پتروتک
نکات کلیدی در انتخاب بهترین کود برای گیاهان آپارتمانی
نمایشگاه بینالمللی عرب پلاست
نمایشگاه بینالمللی ایران کانمین
چهاردهمین نمایشگاه بینالمللی ایران نانو
هفدهمین نمایشگاه بینالمللی ایرانپلاست ۲۰۲۳
همه چیز درباره رزینها | انواع رزین و کاربرد آنها
کافئین چیست و چه اثراتی بر بدن دارد؟ – روش تولید تجاری کافئین